Aminoácidos y La Estructura Primaria de las Proteínas
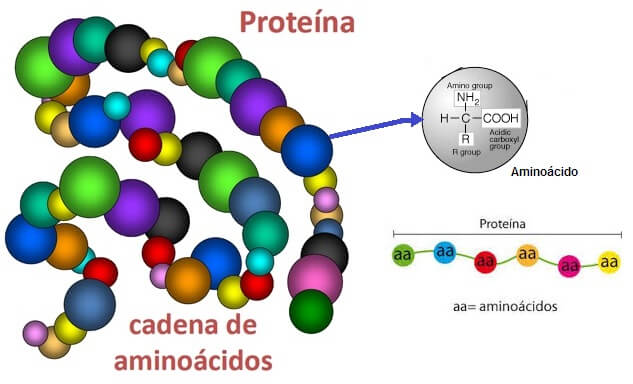
Los aminoácidos son compuestos orgánicos que se combinan para formar proteínas. Los aminoácidos y las proteínas son los pilares fundamentales de la vida.
Las funciones biológicas de las proteínas son las siguientes:
1. Muchas proteínas actúan como enzimas, los catalizadores bioquímicos. Las enzimas catalizan casi todas las reacciones que suceden en los organismos vivos.
2. Algunas proteínas se unen con otras moléculas para su almacenamiento y transporte. Por ejemplo, la mioglobina se enlaza con el oxígeno en las células de los músculos esquelético y cardiaco, mientras que la hemoglobina se une y transporta al O2 y al CO2 en los glóbulos rojos.
3. Algunas proteínas, como la tubulina, actina y colágena, proporcionan soporte y forma a las células, y en consecuencia a los tejidos y los organismos.
4. Los conjuntos de proteínas pueden efectuar trabajo mecánico, como el movimiento de flagelos, la separación de cromosomas en la mitosis y la contracción de los músculos.
5. Muchas proteínas desempeñan un papel en la descodificación de la información celular. Algunas intervienen en la traducción, mientras que otras juegan un papel en la regulación de la expresión genética al unirse a los ácidos nucleicos.
6. Algunas proteínas son hormonas que regulan las actividades bioquímicas en las células o los tejidos blancos; otras proteínas sirven como receptores de las hormonas.
7. Algunas proteínas desarrollan funciones muy especializadas. Por ejemplo, los anticuerpos defienden a los vertebrados contra infecciones bacterianas y víricas, y las toxinas, que producen algunas bacterias, matan organismos mayores.
Todos los organismos emplean los mismos 20 aminoácidos como bloques constructivos para armar las moléculas de proteína. A estos 20 aminoácidos se les llama aminoácidos comunes, estándar o normales. A pesar de la poca cantidad de los aminoácidos, se puede obtener una variedad enorme de distintos polipéptidos al unir los 20 aminoácidos comunes para formar distintas combinaciones. Los aminoácidos se llaman así porque son derivados aminados de ácidos carboxílicos. En los 20 aminoácidos comunes, los grupos amino y carboxilo están unidos al mismo átomo de carbono: el átomo de carbono a. Así, todos los aminoácidos estándar que contienen las proteínas son a-aminoácidos. Al carbono a se unen otros dos sustituyentes: un átomo de hidrógeno y una cadena lateral (R) que es única para cada aminoácido. En los nombres químicos de los aminoácidos, los átomos de carbono se identifican con números que comienzan en el átomo de carbono del grupo carboxilo. [El nombre químico correcto, o nombre sistemático, se apega a reglas establecidas por la Unión Internacional de Química Pura y Aplicada (IUPAC, de International Union of Pure and Applied Chemistry) y la Unión Internacional de Bioquímica y Biología Molecular (IUBMB, de International Union of Biochemistry and Molecular Biology)
Las estructuras de los 20 aminoácidos que suelen encontrarse en las proteínas se muestran en las figuras siguiente:
A. Grupos Alifáticos
La glicina (Gly, G) es el aminoácido más pequeño porque su grupo R no es más que un átomo de hidrógeno; en consecuencia, el carbono a de la glicina no es quiral. Los dos átomos de hidrógeno del carbono ade la glicina imparten poco carácter hidrofóbico a la molécula. Después habrá oportunidad de comprobar que la glicina desempeña un papel único en la estructura de muchas proteínas porque su cadena lateral es lo bastante pequeña como para tener cabida en nichos en los que a otros aminoácidos les resultaría imposible hacerlo.
Hay cuatro aminoácidos: alanina (Ala, A), valina (Val, V), leucina (Leu, L) y el isómero estructural de la leucina, isoleucina (Ile, I), que tienen cadenas laterales alifáticas saturadas. La cadena lateral de la alanina es un grupo metilo, mientras que la valina presenta una cadena lateral ramificada con tres carbonos, y la leucina y la isoleucina contienen una cadena lateral ramificada de cuatro carbonos cada una. Los átomos de carbono a y b de la isoleucina son asimétricos. Ya que la isoleucina tiene dos centros quirales, posee cuatro estereoisómeros posibles.
B. Grupos Aromáticos
La fenilalanina (Phe, F), tirosina (Tyr, Y) y el triptófano (Trp, W) presentan cadenas laterales con grupos aromáticos. En el caso de la fenilalanina es una cadena hidrofóbica bencílica. La tirosina se parece estructuralmente a la fenilalanina; en la tirosina, un grupo hidroxilo sustituye al hidrógeno para de la fenilalanina lo que la convierte en un fenol. El grupo hidroxilo de la tirosina es ionizable, pero bajo condiciones fisiológicas normales retiene su hidrógeno. La cadena lateral del triptófano contiene un grupo indol bicíclico. La tirosina y el triptófano no son tan hidrofóbicos como la fenilalanina porque en sus cadenas laterales hay grupos polares. Los tres aminoácidos aromáticos absorben luz ultravioleta (UV) porque, a diferencia de los aminoácidos alifáticos, los aromáticos contienen electrones p deslocalizados. A pH neutro tanto el triptófano como la tirosina absorben luz a una longitud de onda de 280 nm, mientras que la fenilalanina es casi transparente a 280 nm y absorbe débilmente luz a 260 nm. Dado que la mayor parte de las proteínas contienen triptófano y tirosina éstas absorben luz a 280 nm. La absorbencia a 280 nm se usa en forma rutinaria para estimar la concentración de proteínas en las soluciones.
C. Grupos Azufrados
La metionina (Met, M) y la cisteína (Cys, C) son los dos aminoácidos azufrados. La metionina contiene un grupo tioéter metilo, no polar, en su cadena lateral, lo que la convierte en uno de los aminoácidos más hidrofóbicos. La metionina desempeña un papel especial en la síntesis de proteínas porque casi siempre representa el primer aminoácido en una cadena de polipéptido. La estructura de la cisteína se parece a la de la alanina, con un átomo de hidrógeno reemplazado por un grupo sulfhidrilo(-SH). Aunque la cadena lateral de la cisteína es algo hidrofóbica, también es muy reactiva. Debido a que el átomo de azufre es polarizable, el grupo sulfhidrilo de la cisteína puede formar puentes de hidrógeno débiles con el oxígeno y el nitrógeno. Además, el grupo sulfhidrilo de la cisteína es un ácido débil, lo cual le permite perder un protón y transformarse en un ion tiolato con carga negativa.
D. Cadenas Laterales con grupo Alcohol
La serina (Ser, S) y la treonina (Thr, T) tienen cadenas laterales polares sin carga que contienen grupos b-hidroxilo. Estos grupos alcohol dan carácter hidrofílico a las cadenas laterales alifáticas. Además de la cadena lateral fenólica más ácida de la tirosina, los grupos hidroxilo de la serina y la treonina despliegan las propiedades débiles de ionización de los alcoholes primarios y secundarios. El grupo hidroximetilo de la serina (—CH2OH) no se ioniza en forma apreciable en soluciones acuosas; empero, este alcohol puede reaccionar dentro de los sitios activos de varias enzimas como si estuviera ionizado. La treonina, como la isoleucina, cuenta con dos centros quirales, los átomos de carbono a y b. La L-treonina es el único de los cuatro estereoisómeros que se encuentra con frecuencia en las proteínas. (Los otros estereoisómeros son D-treonina, L-alotreonina y D-alotreonina).
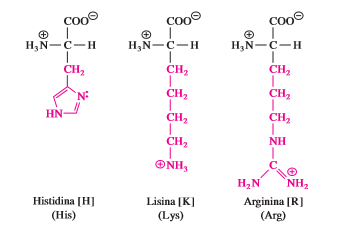
E. Grupo R Basico
La histidina (His, H), lisina (Lys, K) y arginina (Arg, R) presentan cadenas laterales hidrofílicas que son bases nitrogenadas y tienen carga positiva a pH 7. La cadena lateral de la histidina contiene un sustituyente de anillo de imidazol. La forma protonada de este anillo se llama ion imidazolio (sección 3.4). La lisina es un diaminoácido y tiene grupos amino a y e al mismo tiempo. El grupo e-amino existe como ion alquilamonio (—CH2 —NH3 ) a pH neutro y confiere una carga positiva a las proteínas. La arginina es el más básico de los 20 aminoácidos porque su cadena lateral de ion guanidinio está protonada bajo todas las condiciones que se encuentran de manera habitual dentro de una célula. Las cadenas laterales de arginina también aportan cargas positivas a las proteínas.
F. Grupos R acidos y sus amidas derivadas
El aspartato (Asp, D) y el glutamato (Glu, E) son aminoácidos dicarboxílicos y tienen cadenas laterales hidrofílicas con carga negativa a pH 7. Además de los grupos carboxilo a, el aspartato posee un grupo carboxilo b y el glutamato un grupo carboxilo g. El aspartato y el glutamato confieren carga negativa a las proteínas porque sus cadenas laterales se encuentran ionizadas a pH 7. A veces se les llama ácido aspártico y ácido glutámico, respectivamente, pero bajo la mayoría de las condiciones fisiológicas se encuentran como bases conjugadas y, al igual que otros carboxilatos, tienen el sufijo ato. Es probable que el glutamato sea conocido bajo la forma de su sal monosódica, el glutamato monosódico (MSG, de monosodium glutamate), que se usa en alimentos como intensificador de sabores. La asparagina (Asn, N) y la glutamina (Gln, Q) son las amidas del ácido aspártico y el ácido glutámico, respectivamente. Aunque las cadenas laterales de la asparagina y la glutamina son eléctricamente neutras, estos aminoácidos son muy polares y se encuentran con frecuencia en las superficies de las proteínas, donde pueden interactuar con moléculas de agua. Los grupos amida polares de la asparagina y la glutamina también pueden formar puentes de hidrógeno con las cadenas laterales de otros aminoácidos polares.
II. Unión de los aminoácidos por enlaces peptidicos en las proteínas
La secuencia lineal de aminoácidos en una cadena polipeptídica se llama estructura primaria de una proteína. A los niveles más altos de estructura se les llaman estructura secundaria, terciaria y cuaternaria. La estructura de las proteínas se describirá con más detalle en el siguiente capítulo, pero es importante comprender los enlaces peptídicos y la estructura primaria antes de describir algunos de los temas restantes en este capítulo. El enlace que se forma entre los aminoácidos es un enlace de amida y se llama enlace peptídico, o enlace de péptido. Esta unión se puede concebir como el resultado de una condensación simple del grupo carboxilo a de un aminoácido con el grupo amino a del otro. Observe que se pierde una molécula de agua de los aminoácidos que se condensan en la reacción.. A diferencia de los grupos carboxilo y amino de los aminoácidos libres en solución, los grupos que intervienen en los enlaces peptídicos no tienen cargas iónicas. Las mitades de aminoácido unidas en una cadena polipeptídica se llaman residuos de aminoácido. Los nombres de los residuos se forman sustituyendo la terminación -ina o -ato por -ilo (o -il, en nombres compuestos). Por ejemplo, un residuo de glicina en un polipéptido se llama glicilo y un residuo de glutamato se llama glutamilo. En los casos de asparagina, glutamina y cisteína, -ilo sustituye la –a final para formar asparaginilo, glutaminilo y cisteinilo, respectivamente. La terminación ilo indica que el residuo es una unidad de acilo (estructura que carece del hidroxilo del grupo carboxilo). El grupo amino libre y el grupo carboxilo libre en los extremos opuestos de una cadena de péptido se llaman N-terminal (o terminal N, terminal amino) y C-terminal (o terminal C, terminal carboxilo), respectivamente. Por convención, los residuos de aminoácido en una cadena peptídica se numeran desde el N-terminal hasta el C-terminal y se suelen escribir de izquierda a derecha. Esta convención corresponde a la dirección de la síntesis de la proteína. La síntesis comienza con el aminoácido N-terminal —que casi siempre es metionina— y prosigue en secuencia hacia el C-terminal, agregando uno por uno los residuos.






No hay comentarios:
Publicar un comentario